受体酪氨酸激酶,简称RTKs(receptor tyrosine kinase)是最大的一类酶联受体;Ras是原癌基因c-ras表达的产物,RTKs/Ras是目前研究得比较清楚的一条主要的信号转导途径。
■ 受体的结构特点及类型
● 结构特点 所有的RTKs都是由三个部分组成的:含有配体结合位点的细胞外结构域、单次跨膜的疏水α螺旋区、含有酪氨酸蛋白激酶(RTK)活性的细胞内结构域(图5-47)。
● 已发现50多种不同的RTKs,主要的几种类型包括: 表皮生长因子受体、血小板生长因子受体、胰岛素和胰岛素样生长因子-1 受体等。
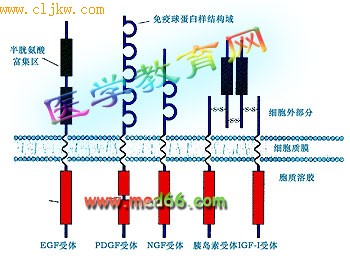
图5-47 几种主要的酪氨酸激酶受体
■ 受体酪氨酸激酶的激活
受体酪氨酸激酶的激活是一个相当复杂的过程,大多数受体都要先由两个单体形成一个二聚体,并在细胞内结构域的尾部磷酸化,然后在二聚体的细胞内结构域装配成一个信号转导复合物(图5-48)。
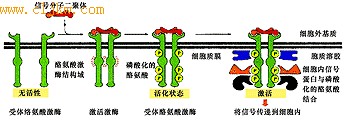
图5-48 受体酪氨酸激酶的激活及细胞内信号转导复合物的形成
受体酪氨酸激酶是如何被激活的?
■ 胰岛素受体信号转导途径
● 受体结构
胰岛素受体(insulin receptor)是一个四聚体,由两个α亚基和两个β亚基通过二硫键连接。
● 激活 当胰岛素与受体的α亚基结合并改变了β亚基的构型后,酪氨酸蛋白激酶才被激活,激活后可催化两个反应∶①使四聚体复合物中β亚基的特异位点酪氨酸残基磷酸化,这种过程称为自我磷酸化(autophosphorylation);②使胰岛素受体底物(insulin receptor substrate,IRSs)上具有重要作用的十几个酪氨酸残基磷酸化(图5-49),磷酸化的IRSs能够与那些具有SH2结构域的蛋白结合,引起进一步的反应。
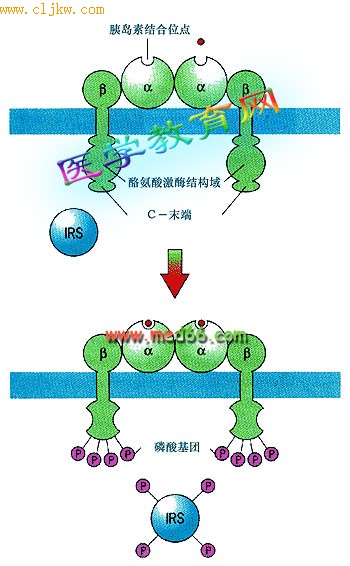
图5-49 胰岛素受体与配体结合反应
胰岛素受体是由两个α亚基和两个β亚基组成的四聚体,胰岛素与α亚基结合引起β亚基构型改变,激活了β亚基的酪氨酸激酶。激活的β亚基将位于受体细胞质结构域的酪氨酸以及受体的各种IRSs磷酸化。
● SH结构域(SH domain)
SH结构域是"Src同源结构域"(Src homology domain)的缩写(Src是一种癌基因,最初在Rous sarcoma virus 中发现),SH2大约由100个氨基酸组成。SH3结构域最初也是在Src中鉴定到的由50个氨基酸组成的组件,后来在其他一些蛋白质中也发现了SH3结构域(图5-50)。
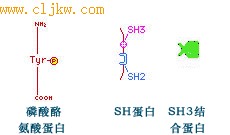
图5-50 磷酸酪氨酸蛋白、SH2 、SH3蛋白和SH3结合蛋白示意图
● 信号转导机制 一旦胰岛素受体被激活、IRSs被磷酸化后,磷酸化的IRSs可以作为一个锚定位点,将许多不同但都具有SH2结构域的蛋白锚定在一起,这些被锚定的蛋白可激活不同的信号转导途径(图5-51),由此将胰岛素受体接受的细胞外信号通过不同的途径传
[1] [2] [3] 下一页
