图9-24 Bip在ER腔中的作用
Bip与转运到ER中蛋白的疏水部分结合,防止蛋白质的变性或降解,使其正确地折叠。结合有蛋白质的Bip在ATP水解后释放被结合的蛋白,如果释放的蛋白仍然是未折叠的,Bip将重新与这种蛋白结合。Bip还可帮助两种不同的蛋白共同装配。
● Bip的第二个作用是防止新合成的蛋白质在转运过程中变性或断裂。通过重组DNA技术,将酵母中编码Bip蛋白的基因突变成温度敏感型后,当提高细胞培养温度时,Bip的功能就会丧失,蛋白质向ER的转移也会停止,推测由于Bip功能的丧失,导致蛋白质在ER中的聚集,抑制了新生肽向ER的转移。
■ 蛋白质在内质网中的修饰
新生肽进入ER腔之后除了要进行正确的折叠之外,还要经过各种不同的修饰之后才能运送到其它的部位。
● N-连接糖基化(N-linked glycosylation)
糖基化的第一步是将一个14糖的核心寡聚糖添加到新形成多肽链的天冬氨酸上,其氨基酸的特征序列是Asn-X-Ser/Thr(X代表任何一种氨基酸), 由于糖是同天冬酰胺的自由NH2连接,所以将这种糖基化称为N-连接的糖基化(图9-25)。
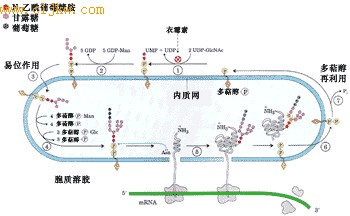
图9-25 正在ER中合成蛋白质的N-连接糖基化
● 羟基化(hydroxylation)
除了N-连接糖基化以外,新生肽的脯氨酸和赖氨酸要进行羟基化,形成羟脯氨酸和羟赖氨酸,不过这种反应只是在少数蛋白上发生。在合成胶原的细胞中,脯氨酸和赖氨酸羟基化则是一个主要的反应。
● 形成脂锚定蛋白[医学教 育网 搜集整理]
新合成的蛋白质除了成为跨膜蛋白或ER腔中的游离蛋白外,还会通过酰基化同ER膜上的糖脂结合,将自己锚定在ER膜上。图9-26是新合成的ER蛋白被信号肽酶从ER上切割之后,立即通过羧基端与已存在于ER膜上的糖基磷脂酰肌醇共价结合,形成脂锚定蛋白的简化过程。形成的脂锚定糖蛋白通过进一步的运输成为质膜外侧的膜蛋白。
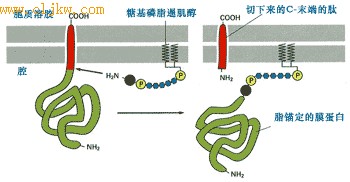
图9-26 蛋白质附着到糖基磷脂酰肌醇成为脂锚定蛋白
● 翻译后跨ER膜运输
某些蛋白质也可通过翻译后跨ER膜运输,由于这些蛋白的信号序列太短而无法与SRP相互作用, 它们主要是靠分子伴侣维持非折叠状态进行跨膜转运。关于翻译后跨ER膜运输的详细机理还不太清楚。
上一页 [1] [2] [3] [4] [5]
